1. Introduzione
Miocardite e pericardite sono state segnalate come una potenziale complicazione dei vaccini COVID-19 mRNA (RNA messaggero). Dalle prime osservazioni di miocardite in risposta al vaccino Pfizer-BioNTech nell’aprile 2021 [ 1 ], sono stati pubblicati numerosi casi clinici, che indicano una relazione tra la vaccinazione COVID-19 e l’insorgenza di miocardite/pericardite [ 2 , 3 , 4 , 5 , 6 , 7 , 8 ].
Nel frattempo, ampi studi epidemiologici rivelano che la maggior parte della miocardite correlata al vaccino COVID-19 si verifica in giovani individui di sesso maschile (età mediana di 21 anni) dopo la seconda dose di vaccini a base di mRNA [ 9 ]. La maggior parte dei casi (76,8%) è stata osservata in risposta al vaccino Pfizer-BioNTech (Comirnaty® ) , mentre un quarto (23,2%) ha ricevuto il vaccino Moderna (Spikevax® ) . Nonostante il numero totale di casi, è stato dimostrato che l’incidenza generale di miocardite è maggiore nei pazienti trattati con Spikevax ® (da 1,3 a 1,9 (Spikevax ® ) e da 0,26 a 0,57 (Comirnaty ®) casi extra di miocardite ogni 10.000 soggetti) [ 10 ]. Di conseguenza, numerose autorità nazionali hanno raccomandato l’uso di Comirnaty ® al posto di Spikevax ® per le persone di età pari o inferiore a 30 anni.
I segni di miocardite dopo la vaccinazione COVID-19 di solito si sviluppano entro 2 settimane [ 11 , 12 ] e i sintomi clinici generalmente regrediscono rapidamente senza compromissione della funzione cardiaca [ 13 ]. Sebbene la miocardite correlata al vaccino COVID-19 abbia un’incidenza marginale complessiva e i pazienti affetti mostrino un rapido recupero in assenza di complicanze a breve termine, la miocardite è un effetto collaterale allarmante, che deve essere monitorato attentamente.
Mentre la maggior parte dei casi pubblicati si basa sulla risonanza magnetica cardiaca (cMRI) e sulla valutazione di laboratorio [ 2 , 3 , 4 , 5 , 6 , 7 ], i casi provati con biopsia endomiocardica (EMB) sono limitati [ 8 , 14 , 15]. Qui, presentiamo un’analisi completa degli EMB di 15 pazienti con sospetto di miocardite dopo la vaccinazione contro SARS-CoV-2 e riveliamo una relazione temporale tra la vaccinazione e l’insorgenza di infiammazione miocardica, che va da una lieve cardiomiopatia infiammatoria a una grave miocardite attiva e miocardite a cellule giganti.
2. Risultati
Le caratteristiche dei pazienti, il quadro clinico ei risultati di laboratorio al ricovero in ospedale sono illustrati nella Tabella 1 . È importante sottolineare che il sospetto di miocardite in risposta alla vaccinazione contro SARS-CoV-2 è stato espresso in tutti i casi. La frazione di eiezione ventricolare sinistra mediana (LVEF) era del 30 (14-39)%. La coorte analizzata va dai 18 ai 68 anni ed è dominata dal sesso maschile (9/15, 60%). Tutti i pazienti erano caucasici. Il tipo di vaccino, l’insorgenza dei sintomi, il sospetto clinico e il decorso clinico differiscono molto nella coorte presentata ( Tabella 1 ).
Tutti gli EMB sono stati testati negativamente per SARS-CoV-2 utilizzando sequenze specifiche del gene E [ 16 ]. Oltre a 10 casi con infezione latente da parvovirus B19, nessun altro patogeno virale inclusi adenovirus, enterovirus, virus Epstein-Barr e herpesvirus umano 6 è stato rilevato nelle biopsie mediante nested- e qRT-PCR ( Tabella 2 ). Da 15 pazienti, due casi di miocardite attiva (AMC, pazienti 1 e 2), due casi di miocardite a cellule giganti (GCMC, pazienti 3 e 14), nove casi di cardiomiopatia infiammatoria (DCMi) e un caso di cardiomiopatia dilatativa (DCM, paziente 12) sono stati diagnosticati sulla base della diagnostica differenziale EMB. La maggior parte dei casi (15/11, 73%; AMC = 2; GCMC = 1; DCMi = 8) è stata osservata in relazione al Comirnaty ®vaccino mRNA e quattro casi (27%) erano correlati ai vaccini vettore Vaxzevria ® (DCMi = 1; DCM = 1) e Janssen ® (AMC = 1; DCMi = 1). L’insorgenza dei sintomi variava da 0 a 56 giorni (mediana 14 giorni) per Comirnaty ® , da 1 a 14 giorni (mediana 7,5 giorni) per Vaxzevria ® e da 14 a 28 giorni (mediana 21 giorni) per Janssen ® .
La maggior parte dei pazienti nel gruppo Comirnaty ® era di sesso maschile (8/11, 73%), mentre il sospetto di miocardite dopo la vaccinazione con i vaccini vettore era principalmente di sesso femminile (1/2 per Janssen ® ; 2/2 per Vaxzevria ® ). L’età media dei pazienti che ricevevano il vaccino Comirnaty ® era di 34 (28–46) anni, dei pazienti che ricevevano Vaxzevria ® 64 (61–66) anni e dei pazienti che ricevevano il vaccino Janssen ® 38 (35–42) anni ( Tabella 1 ).
Tutti i pazienti hanno rivelato un esordio improvviso di grave insufficienza ventricolare sinistra (LVEF ≤ 45%) e la maggior parte presentava sintomi aggiuntivi come dispnea, dolore toracico, frequenza respiratoria ridotta e ridotta capacità di esercizio ( Tabella 1 ). I dati sulla risonanza magnetica cardiaca erano disponibili per sei pazienti, che non mostravano segni di miocardite in quattro di essi (pazienti 2, 4, 5 e 11) e segni tipici di miocardite attiva in due pazienti (pazienti 8 e 9) ( Tabella 1 ). Cinque pazienti hanno mostrato gravi complicazioni tra cui scompenso cardiaco (pazienti 5 e 8, entrambi DCMi) e shock cardiogeno fulminante (paziente 14, GCMC), e due pazienti (pazienti 2 e 3, rispettivamente AMC e GCMC) hanno dovuto essere rianimati prima del ricovero in il reparto di terapia intensiva ( Tabella 1 ). I dati sui biomarcatori cardiaci e infiammatori di laboratorio tra cui troponina, peptide natriuretico cerebrale (BNP), creatinina chinasi (CK) e peptide C-reattivo (CRP) sono eterogenei e sono risultati elevati in 12 su 15 pazienti ( Tabella 1 ).
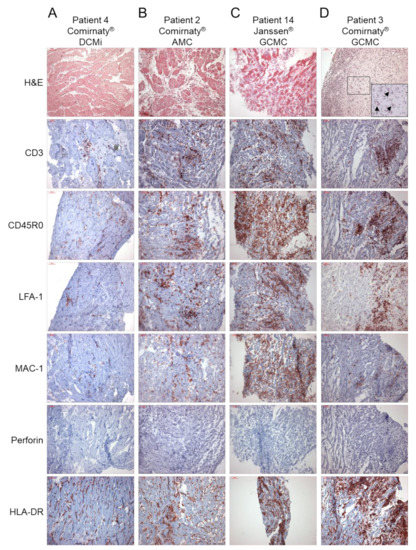
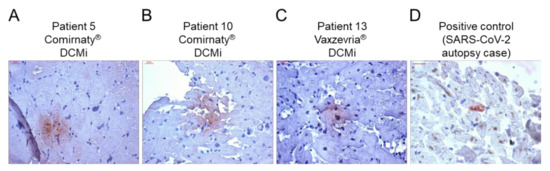
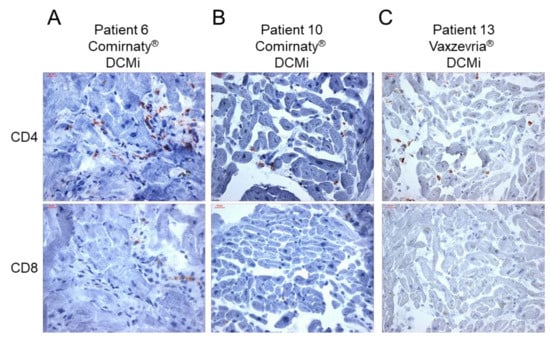
L’analisi immunoistochimica EMB ha rivelato una maggiore presenza di marcatori di infiammazione in 14/15 pazienti ( Figura 1 , Tabella 2 ). È stato riscontrato che solo 1 paziente aveva livelli costantemente bassi di cellule infiammatorie, compatibili con la diagnosi di un DCM (paziente 12, Figura 1 , Tabella 2 ). Tutti gli altri pazienti con infiammazione miocardica hanno mostrato un modello diverso di marcatori infiammatori, che vanno da un grado di infiammazione da lieve a grave. Su 14 pazienti con evidenza di infiammazione, 9 (64%) hanno mostrato un’elevata infiltrazione di cellule T CD3 + , 12 (86%) hanno mostrato livelli aumentati di CD45R0 +Cellule di memoria T e linfociti LFA-1 + , 11 (79%) hanno mostrato un numero maggiore di MAC-1 + macrofagi e cellule presentanti HLA-DR + e nessuno ha mostrato livelli aumentati di perforina + cellule citotossiche ( Figura 1 , Tabella 2 ). Le molecole di adesione cellulare ICAM-1 e VCAM-1 erano normali in tutti i pazienti, ad eccezione di due pazienti con AMC (paziente 2) e GCMC (paziente 14), rispettivamente ( Tabella 2). Un’ulteriore analisi immunoistochimica ha rivelato il rilevamento positivo della proteina spike SARS-CoV-2 nel tessuto cardiaco in un paio di pazienti. In particolare, la proteina spike è stata trovata in cellule sparse (cardiomiociti) in 9 casi su 15 ( Figura 2 , Tabella 2 ). Inoltre, ad eccezione dei casi con miocardite attiva (pazienti 1 e 2), miocardite a cellule giganti (pazienti 3 e 14) e un caso di DCMi (paziente 9), CD4 + -cellule T a CD8 + -cellule T il rapporto era ≥1, suggerendo un’origine prevalentemente autoimmunologica dell’infiammazione osservata ( Figura 3 , Tabella 2 ).
3. Discussione
Nel presente studio, abbiamo identificato 14/15 (93%) pazienti con sospetta miocardite dopo la vaccinazione COVID-19, con infiammazione miocardica comprovata da EMB. Quattro di loro avevano miocardite acuta (inclusa miocardite attiva e miocardite a cellule giganti) e a 10 è stata diagnosticata una cardiomiopatia infiammatoria (DCMi). L’assenza di infiammazione negli EMB di un paziente potrebbe essere spiegata da un errore di campionamento. L’esordio dei sintomi variava da 0 a 56 giorni, che rientra nell’intervallo dei precedenti risultati epidemiologici [ 17]. Anche se non è possibile stabilire una relazione causale, le cause infettive della miocardite sono state escluse dalla diagnostica molecolare dei patogeni virali più rilevanti (incluso SARS-CoV-2). Sebbene i genomi virali latenti di B19V siano stati trovati in 10/15 (67%) casi, la trascrizione attiva di B19V non è stata confermata in questi pazienti. B19V è la specie virale più frequentemente rilevata nel cuore umano e il suo contributo all’infiammazione miocardica e quindi all’esito a lungo termine del paziente, dipende fortemente dalla sua attività trascrizionale [ 18 , 19 ]. Pertanto, le infezioni latenti identificate da B19V sono improbabili causa dell’infiammazione miocardica in questi pazienti.
Poiché le infezioni virali sono state escluse come causa di miocardite/infiammazione miocardica, i meccanismi autoimmunologici potrebbero essere una spiegazione. La reattività crociata degli anticorpi della proteina spike con le proteine contrattili del miocardio, la reattività immunitaria dell’mRNA e il coinvolgimento ormonale sono stati discussi come potenziali meccanismi mediante i quali i vaccini mRNA COVID-19 inducono iperimmunità [ 20 ]. Nella coorte attuale, la proteina spike SARS-CoV-2 è stata trovata espressa sui cardiomiociti in 9 su 15 pazienti. Pertanto, la proteina spike codificata dal vaccino sembra raggiungere il cuore, dove potrebbe innescare una risposta infiammatoria, con conseguente sviluppo di miocardite o DCMi. Precedenti dati sui topi indicavano un’espressione intramiocardica della proteina spike dopo la vaccinazione con mRNA [ 21 ]; tuttavia, i dati umani sono scarsi. È interessante notare che, ad eccezione di cinque casi (AMC = 2, GCMC = 2 e DCMi = 1), il numero di linfociti CD4 + T era uguale o superiore a quello dei linfociti T CD8 + . Nella miocardite acuta, è noto uno spostamento del rapporto CD4-CD8 verso le cellule T CD8 + [ 22 ], che spiega l’aumento delle cellule CD8 + nei pazienti con AMC e GCMC. Tuttavia, poiché i linfociti T CD4 + sono considerati il principale fattore di miocardite autoimmune [ 20], i nostri dati supportano l’idea che l’infiammazione miocardica indotta dal vaccino sia una conseguenza dell’eccessiva infiltrazione di cellule T CD4 + e, quindi, un potenziale fattore di danno miocardico autoimmunologico. Inoltre, l’espressione di HLA-DR era aumentata in 11 su 14 (79%) pazienti con infiammazione evidente. A causa del fatto che le regioni HLA di classe II sono fortemente associate a diverse malattie autoimmuni [ 20 ], l’induzione di HLA-DR in risposta alla vaccinazione supporta un contributo autoimmunologico all’infiammazione miocardica dopo la vaccinazione. L’espressione delle molecole di adesione ICAM-1 e VCAM-1 sull’endotelio cardiaco (micro)vascolare è sovraregolata in caso di infezione da virus associati alla miocardite [ 23]. Oltre a un paziente con AMC (paziente 2) e un paziente con GCMC (paziente 14), nessuno dei pazienti ha mostrato livelli aumentati di ICAM-1 e VCAM-1, a sostegno di un’origine non infettiva dell’infiammazione osservata. È noto che il danno cardiaco mediato dalla perforina è coinvolto nella miocardite virale [ 24 , 25 ] e idiopatica acuta [ 26 ]. È interessante notare che nessuno dei pazienti ha mostrato una maggiore presenza di cellule perforina + , indicando nessun contributo di eventi citotossici a seguito della vaccinazione COVID-19. Inoltre, i dati sulle cellule di perforina + in pazienti con LVEF ridotta mostrano che la mancanza di perforina +infiltrati cardiaci è associato a un miglioramento spontaneo della LVEF [ 23 ]. Pertanto, si potrebbe presumere un miglioramento della funzione cardiaca, come descritto per la maggior parte dei pazienti con miocardite correlata al vaccino [ 13 ].
Tra la diagnostica EMB, sono state utilizzate tecniche di imaging non invasive per identificare la miocardite correlata al vaccino COVID-19 [ 2 , 3 , 4 , 5 , 6 , 7 ]. Oltre ai marcatori cMRI come il rapporto ponderato T2, il potenziamento precoce del gadolinio e il potenziamento tardivo del gadolinio all’interno dei criteri di Lake Louise e la tomografia a emissione di positroni del recettore della somatostatina/tomografia computerizzata (PET/TC) sono stati applicati per la diagnosi di miocardite in seguito alla vaccinazione COVID-19. 27]. Tuttavia, poiché le tecniche di imaging cardiaco forniscono informazioni utili ma limitate sull’infiammazione miocardica grave, non sono in grado di correlare con un’infiammazione lieve e la persistenza virale. La presente serie di casi rivela che la cMRI è stata in grado di rilevare l’infiammazione miocardica solo nel 33,3% (2/6) dei casi ( Tabella 1 ). Pertanto, l’EMB rimane lo standard definito nella diagnosi della cardiomiopatia virale e infiammatoria.
Limitazioni allo studio
Ci sono diversi limiti di questo studio che devono essere considerati quando si interpretano i risultati ottenuti. In primo luogo, nessuna causalità può essere assunta o stabilita a causa della mancanza di un gruppo di controllo e del carattere osservativo di una serie di casi. Sebbene siano state escluse altre cause di infiammazione miocardica, nei casi presentati non ci sono prove dirette di una risposta infiammatoria indotta dal vaccino. In secondo luogo, non è possibile determinare un’incidenza di miocardite/cardiomiopatia infiammatoria mediata da vaccino a causa dell’approccio selettivo di scelta dei casi con sospetto di miocardite dopo la vaccinazione COVID-19 e la disponibilità simultanea di EMB. Terzo, mancano dati clinici estesi per tutti i pazienti trattati in questo studio multicentrico, e i dati clinici e le valutazioni sono stati raccolti da diversi medici. Infine, il tipo di vaccino e l’insorgenza dei sintomi dopo la prima o la seconda dose differiscono tra i casi e sono quindi difficili da confrontare.
4. Materiali e metodi
4.1. Pazienti e indagini cliniche
In questo studio multicentrico sono stati inclusi in totale 15 pazienti (età media 38 (31–52) anni; 9 uomini) provenienti da 11 diverse cliniche. Per tutti i pazienti il sospetto clinico di miocardite dopo vaccinazione COVID-19 è stato espresso dal medico curante per una relazione temporale tra la vaccinazione e l’insorgenza dei sintomi della miocardite. Tutti i pazienti sono stati sottoposti a indagini cliniche chiave tra cui test di laboratorio, ecocardiografia ed elettrocardiogramma e alcuni pazienti ( n = 6) sono stati sottoposti ad ulteriore risonanza magnetica cardiaca (cMRI) [ 28]. Inoltre, gli EMB sono stati ottenuti da ciascun paziente e inviati all’Istituto per la diagnostica e la terapia cardiaca (IKDT, Berlino, Germania), per il lavoro di routine tra cui istologia, immunoistochimica e virologia molecolare. La decisione di eseguire l’EMB è stata presa dal medico curante sulla base dell’impostazione di insufficienza cardiaca inspiegabile e insorgenza improvvisa di grave insufficienza ventricolare sinistra [ 29 ]. La malattia coronarica e altre possibili cause di disfunzione miocardica sono state escluse dall’angiografia prima dell’EMB in tutti i pazienti. La frazione di eiezione ventricolare sinistra (LVEF) è stata determinata mediante ecocardiografia con il metodo Simpson. Tutti i dati numerici sono presentati con intervallo mediano e interquartile.
4.2. Virologia molecolare degli EMB
Immediatamente dopo il ritiro degli EMB, i campioni sono stati trasferiti in una soluzione RNAlater per la stabilizzazione degli acidi nucleici (Thermo Fisher Scientific, Waltham, MA, USA). Il DNA totale è stato estratto dai kit Gentra Puregene (Qiagen, Hilden, Germania) secondo le istruzioni del produttore [ 16 ]. L’isolamento dell’RNA totale è stato eseguito utilizzando il reagente TRIzol (Thermo Fisher Scientific, Waltham, MA, USA), seguito dal trattamento della DNAsi (Promega, Walldorf, Germania) e dalla sintesi del cDNA utilizzando il kit di trascrizione inversa del cDNA ad alta capacità (Thermo Fisher Scientific, Waltham, MA , USA) e primer esamerici casuali (Thermo Fisher Scientific, Waltham, MA, USA) [ 19]. Quindi, il rilevamento dei genomi virali tra cui Parvovirus B19 (B19V), Enterovirus (tra cui Coxsackievirus B3 ed Echovirus), Adenovirus, virus Epstein-Barr, Herpesvirus 6 umano e Sindrome respiratoria acuta grave Coronavirus 2 (SARS-CoV-2) è stato ottenuto utilizzando reazione a catena della polimerasi annidata (nidificata-PCR) e trascrittasi inversa quantitativa (qRT)-PCR, come descritto prima [ 19 , 30 ].
4.3. Istologia, immunoistochimica e analisi di imaging digitale
Gli esami istologici sono stati eseguiti su campioni fissati in formalina e inclusi in paraffina colorati con ematossilina ed eosina (H & E) e coloranti tricromi secondo procedure standard [ 31 ]. La miocardite attiva è stata diagnosticata secondo i criteri istomorfologici di Dallas [ 32 ]. Per la qualificazione e la quantificazione degli infiltrati infiammatori, la colorazione immunoistochimica è stata eseguita su EMB fissati con RNAlater e crio-embedded, come descritto in precedenza [ 31 ]. L’infiammazione miocardica è stata diagnosticata dalla presenza di ≥14 leucociti con la presenza di cellule T CD3 + secondo la posizione della Società Europea di Cardiologia (ESC) [ 33 ]. Inoltre, il numero di linfociti CD11a + /LFA-1 + (soglia ≥ 14 cellule/mm 2 ), CD11b + /MAC-1 + macrofagi (soglia ≥ 40 cellule/mm 2 ), CD45R0 + ) e cellule presentanti HLA-DR + (soglia ≥ 4,6 area%) sono state determinate. Inoltre, rapporto di CD4 +Cellule di memoria T (soglia ≥ 50 cellule/mm 2 ), perforina + cellule citotossiche (soglia ≥ 2,9 cellule/mm 2 -to-CD8 + cellule T sono state analizzate. L’attivazione tissutale ed endoteliale è stata misurata mediante l’espressione della molecola di adesione intercellulare 1 (ICAM-1, soglia ≥ 2,8 area%) e molecola di adesione cellulare 1 (VCAM-1, soglia ≥ 0,08 area%).Tutti i marcatori immunoistochimici sono stati quantificati mediante analisi di imaging digitale, come descritto in precedenza [ 23 ].Rilevamento della SARS La proteina spike -CoV-2 è stata eseguita su EMB inclusi in paraffina utilizzando un anticorpo appropriato (GeneTex, 1A9, GTX632604; 1:100) [ 34 ]. Come controllo positivo è stato utilizzato il tessuto cardiaco dell’autopsia da un paziente confermato da SARS-CoV-2 qRT-PCR.
5. Conclusioni
Il presente studio riassume la diagnostica basata su EMB di 15 pazienti con sospetto clinico di miocardite dopo la vaccinazione contro SARS-CoV-2. Identifica 14 dei 15 pazienti con infiammazione miocardica, che vanno dalla cardiomiopatia infiammatoria alla miocardite attiva e alla miocardite a cellule giganti grave. Sebbene non sia possibile stabilire una relazione causale tra la vaccinazione e l’insorgenza dell’infiammazione miocardica sulla base dei risultati, il rilevamento cardiaco della proteina spike, l’infiammazione dominata dai linfociti T CD4 + e la stretta relazione temporale sostengono una reazione autoimmune innescata dal vaccino.
Contributi dell’autore
Concettualizzazione, CB, FE e H.-PS; metodologia, CB, GA e DH; analisi formale, CB, GA, DH e UG; indagine, CB, GA, DH, UG, CH, BA, RW, MK, SR, PW, TM, AE, MG, CP, AB, MF, TK, JB e FE; scrittura—preparazione della bozza originale, CB; scrittura—revisione e montaggio, CB; acquisizione del finanziamento, GA, FE e H.-PS Tutti gli autori hanno letto e accettato la versione pubblicata del manoscritto.
Finanziamento
Questa ricerca è stata finanziata da una sovvenzione Profit di INVESTITIONSBANK BERLIN (IBB)/cofondata dal Fondo europeo di sviluppo regionale (EFRE), numeri di sovvenzione 10169096, 10169098, 10169028.
Dichiarazione del comitato di revisione istituzionale
Lo studio è stato condotto in conformità con la Dichiarazione di Helsinki e approvato dall’Institutional Review Board presso Campus Benjamin Franklin, Charité, Berlino (EA4/236/20, 27 dicembre 2020).
Dichiarazione di consenso informato
Il consenso informato è stato ottenuto da tutti i soggetti coinvolti nello studio.
Dichiarazione sulla disponibilità dei dati
Tutti gli autori confermano che tutti i dati correlati a supporto dei risultati di questo studio sono riportati nell’articolo.
Ringraziamenti
Gli autori ringraziano Susanne Ochmann, Kitty Winter, Jenny Klostermann, Katrin Errami (IKDT Berlin) e Hannes Jarmuth (Charite Berlin) per la loro abile assistenza tecnica. Inoltre, ringraziamo Dirk Westermann e Diana Lindner dell’University Heart and Vascular Center Hamburg per aver fornito il controllo positivo per SARS-CoV-2.
Conflitto di interessi
Gli autori dichiarano assenza di conflitto di interesse. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio; nella raccolta, analisi o interpretazione di dati; nella stesura del manoscritto, o nella decisione di pubblicare i risultati.
Riferimenti
- Centri CDC per il controllo e la prevenzione delle malattie. Miocardite e pericardite dopo vaccinazione con MRNA COVID-19. Disponibile online: https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/myocarditis.html (visitato il 6 aprile 2022).
- Minocha, PK; Meglio, D.; Singh, RK; Hoque, T. Recidiva di miocardite acuta temporalmente associata alla ricezione del vaccino MRNA Coronavirus 2019 (COVID-19) in un adolescente maschio. J. Pediatr. 2021 , 238 , 321–323. [ Google Scholar ] [ CrossRef ]
- Muthukumar, A.; Narasimhan, M.; Li, Q.-Z.; Mahimainathan, L.; Hitto, I.; Fuda, F.; Batra, K.; Jiang, X.; Zhu, C.; Schoggins, J.; et al. Valutazione approfondita di un caso di presunta miocardite dopo la seconda dose di vaccino MRNA COVID-19. Diffusione 2021 , 144 , 487–498. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- McLean, K.; Johnson, miopericardite TJ in un maschio adolescente precedentemente sano dopo la vaccinazione COVID-19: un caso clinico. Accad. emergere Med. 2021 , 28 , 918–921. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- D’Angelo, T.; Cattafi, A.; Carerj, ML; Booz, C.; Ascenti, G.; Cicerone, G.; Blandino, A.; Mazziotti, S. Miocardite dopo la vaccinazione SARS-CoV-2: una reazione indotta dal vaccino? Può. J. Cardiol. 2021 , 37 , 1665–1667. [ Google Scholar ] [ CrossRef ]
- Alberto, E.; Aurigemma, G.; Salsa, J.; Gerson, miocardite con DS dopo la vaccinazione contro il COVID-19. Radiol. Caso Rep. 2021 , 16 , 2142–2145. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bautista Garcia, J.; Peña Ortega, P.; Bonilla Fernández, JA; Cardenes León, A.; Ramirez Burgos, L.; Caballero Dorta, E. Miocardite acuta dopo la somministrazione del vaccino BNT162b2 contro COVID-19. Rev. Española Cardiol. 2021 , 74 , 812–814. [ Google Scholar ] [ CrossRef ]
- Nagasaka, T.; Koitabashi, nord; Ishibashi, Y.; Aihara, K.; Takama, nord; Ohyama, Y.; Yokoyama, T.; Kaneko, Y. Miocardite acuta associata alla vaccinazione COVID-19: un caso clinico. J. Cardiol. Casi 2021 , 25 , 285–288. [ Google Scholar ] [ CrossRef ]
- Mattia, A.; Kunadharaju, R.; Osman, M.; Jesme, C.; McMiller, Z.; Johnson, EM; Mattia, D.; Kallamadi, R.; Bande, D. Presentazione clinica e risultati della miocardite dopo la vaccinazione con MRNA: una meta-analisi e una revisione sistematica. Curato 2021 , 13 , e19240. [ Google Scholar ] [ CrossRef ]
- Punti salienti della riunione dell’Agenzia europea per i medicinali dal Comitato di valutazione dei rischi per la farmacovigilanza (PRAC) dal 29 novembre al 2 dicembre 2021. Disponibile online: https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment- comitato-prac-29-novembre-2-dicembre-2021 (accesso 1 aprile 2022).
- Verma, AK; Lavine, KJ; Lin, C.-Y. Miocardite dopo vaccinazione con MRNA COVID-19. N. ingl. J. Med. 2021 , 385 , 1332–1334. [ Google Scholar ] [ CrossRef ]
- Viskin, D.; Topilsky, Y.; Aviram, G.; Mann, T.; Sadone, S.; Hadad, Y.; Flint, N.; Shmilovich, H.; Banai, S.; Havakuk, O. Miocardite associata alla vaccinazione COVID-19: ecocardiografia, tomografia cardiaca e risultati di imaging a risonanza magnetica. Circo. cardiovascolare. Imaging 2021 , 14 , e013236. [ Google Scholar ] [ CrossRef ]
- Salah, Sua Maestà; Vaccino Mehta, JL COVID-19 e miocardite. Sono. J. Cardiol. 2021 , 157 , 146–148. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kadwalwala, M.; Chadha, B.; Ortoleva, J.; Joyce, M. Imaging multimodale e istopatologia in un giovane che si presenta con miocardite linfocitica fulminante e shock cardiogeno dopo la vaccinazione con MRNA-1273. Caso BMJ Rep. 2021 , 14 , e246059. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ehrlich, P.; Klingel, K.; Ohlmann-Knafo, S.; Huttinger, S.; Sood, N.; Pickuth, D.; Kindermann, M. Miocardite linfocitica provata da biopsia dopo la prima vaccinazione con MRNA COVID-19 in un maschio di 40 anni: caso clinico. Clin. ris. cardiolo. 2021 , 110 , 1855–1859. [ Google Scholar ] [ CrossRef ]
- Escher, F.; Pietsch, H.; Alescheva, G.; Bock, T.; Baumeier, C.; Elsaesser, A.; Wenzel, P.; Hamm, C.; Westenfeld, R.; Schultheiss, M.; et al. Rilevazione dei genomi virali SARS-CoV-2 e dei cambiamenti istopatologici nelle biopsie endomiocardiche. ESC Ascolta. Fallire. 2020 , 7 , 2440–2447. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Witberg, G.; Barda, N.; Hoss, S.; Richter, I.; Wiessman, M.; Aviv, Y.; Grinberg, T.; Auster, O.; Dagan, N.; Balicer, RD; et al. Miocardite dopo la vaccinazione COVID-19 in una grande organizzazione sanitaria. N. ingl. J. Med. 2021 , 385 , 2132–2139. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Escher, F.; Alescheva, G.; Pietsch, H.; Baumeier, C.; Lordo, UM; Schrage, BN; Westermann, D.; Bock, C.-T.; Schultheiss, H.-P. L’infezione trascrizionale da parvovirus B19 attivo predice un esito negativo a lungo termine nei pazienti con cardiomiopatia non ischemica. Biomedicine 2021 , 9 , 1898. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Pietsch, H.; Escher, F.; Alescheva, G.; Lassner, D.; Bock, C.-T.; Schultheiss, H.-P. Rilevamento degli MRNA del parvovirus come marker per l’attività virale nella diagnosi basata sulla biopsia endomiocardica di pazienti con insufficienza cardiaca inspiegabile. Sci. Rep. 2020 , 10 , 22354. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Vdovenko, D.; Eriksson, U. Ruolo regolatorio delle cellule T CD4 + nella miocardite. J. Immunol. ris. 2018 , 2018 , 4396351. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Li, C.; Chen, Y.; Zhao, Y.; Polmone, DC; Sì, Z.; Canzone, W.; Liu, F.-F.; Cai, J.-P.; Wong, W.-M.; Sì, CC-Y.; et al. Il vaccino MRNA per iniezione endovenosa della malattia di Coronavirus 2019 (COVID-19) può indurre la miopericardite acuta nel modello murino. Clin. Infettare. Dis. 2021 , 73 , 2372–2373. [ Google Scholar ] [ CrossRef ]
- Jurcova, I.; Rocek, J.; Bracamonte-Baran, O.; Zelizko, M.; Netuka, I.; Maluskova, J.; Kautzner, J.; Cihakova, D.; Melenovsky, V.; Maly, J. Recupero completo della miocardite mediata da cellule T CD8 citotossica fulminante dopo lo scarico di ECMELLA e l’immunosoppressione. ESC Scompenso cardiaco 2020 , 7 , 1976–1981. [ Google Scholar ] [ CrossRef ]
- Escher, F.; Kuhl, U.; Lassner, D.; Stroux, A.; Lordo, U.; Westermann, D.; Pieske, B.; Poller, W.; Schultheiss, H. L’infiltrazione cellulare cardiaca altamente perforina-positiva e il sesso maschile predicono una mortalità avversa a lungo termine nei pazienti con cardiomiopatia infiammatoria. Marmellata. Cuore Assoc. 2017 , 6 , e005352. [ Google Scholar ] [ CrossRef ]
- Gebhard, JR; Perry, CM; Harkins, S.; Corsia, T.; Mena, I.; Asensio, VC; Campbell, IL; Whitton, Miocardite indotta da JL Coxsackievirus B3. Sono. J. Pathol. 1998 , 153 , 417–428. [ Google Scholar ] [ CrossRef ]
- Seko, Y.; Shinkai, Y.; Kawasaki, A.; Yagita, H.; Okumura, K.; Takaku, F.; Yazaki, Y. Espressione della perforina nelle cellule infiltranti nei cuori murini con miocardite acuta causata da Coxsackievirus B3. Circolazione 1991 , 84 , 788–795. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Giovane, L.; Joag, S.; Zheng, L.; Giovane, J.; Lee, C.; Lee, Y. Danno miocardico mediato dalla perforina nella miocardite acuta. Lancetta 1990 , 336 , 1019–1021. [ Google Scholar ] [ CrossRef ]
- Bollano, E.; Bergh, N.; Dudas, A.; Bobbio, E.; Polte, CL Tomografia a emissione di positroni del recettore della somatostatina/tomografia computerizzata nella miocardite dopo la vaccinazione con MRNA COVID-19. Euro. Ascoltare. J. Caso Rep. 2022 , 6 , ytac117. [ Google Scholar ] [ CrossRef ]
- Lampejo, T.; Durkin, SM; Bhatt, N.; Guttmann, O. Miocardite acuta: eziologia, diagnosi e gestione. Clin. Med. 2021 , 21 , e505–e510. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Cooper, LT; Baughman, KL; Feldman, AM; Frustaci, A.; Jessup, M.; Kuhl, Stati Uniti; Levine, GN; Narula, J.; Storno, RC; Towbin, J.; et al. Il ruolo della biopsia endomiocardica nella gestione delle malattie cardiovascolari. Circolazione 2007 , 116 , 2216–2233. [ Google Scholar ] [ CrossRef ]
- Pietsch, H.; Escher, F.; Alescheva, G.; Baumeier, C.; Morawietz, L.; Elsaesser, A.; Schultheiss, H.-P. Prova dei genomi SARS-CoV-2 nella biopsia endomiocardica con latenza dopo un’infezione acuta. int. J. Infetta. Dis. 2021 , 102 , 70–72. [ Google Scholar ] [ CrossRef ]
- Baumeier, C.; Escher, F.; Alescheva, G.; Pietsch, H.; Schultheiss, H.-P. L’inibitore dell’attivatore del plasminogeno-1 riduce la fibrosi cardiaca e promuove la polarizzazione dei macrofagi M2 nella cardiomiopatia infiammatoria. Ris. di base cardiolo. 2021 , 116 , 1. [ Google Scholar ] [ CrossRef ]
- Aretz, Miocardite HT: i criteri di Dallas. Ronzio. Patolo. 1987 , 18 , 619–624. [ Google Scholar ] [ CrossRef ]
- Caforio, ALP; Pankuweit, S.; Arbustini, E.; Basso, C.; Gimeno-Blanes, J.; Felice, Sai Baba; Fu, M.; Helio, T.; Heymans, S.; Jahns, R.; et al. Stato attuale delle conoscenze su eziologia, diagnosi, gestione e terapia della miocardite: una dichiarazione di posizione del gruppo di lavoro della Società europea di cardiologia sulle malattie del miocardio e del pericardio. Euro. Cuore J. 2013 , 34 , 2636–2648. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dal Ferro, M.; Bussani, R.; Paldino, A.; Nuzzi, V.; Collesi, C.; Zentilin, L.; Schneider, E.; Correa, R.; Silvestri, F.; Zacchigna, S.; et al. SARS-CoV-2, lesione miocardica e infiammazione: approfondimenti da un ampio studio clinico e autoptico. Clin. ris. cardiolo. 2021 , 110 , 1822–1831. [ Google Scholar ] [ CrossRef ] [ PubMed ]
|
Nota dell’editore: MDPI rimane neutrale per quanto riguarda le rivendicazioni giurisdizionali nelle mappe pubblicate e nelle affiliazioni istituzionali.
|
© 2022 degli autori. Licenziatario MDPI, Basilea, Svizzera. Questo articolo è un articolo ad accesso aperto distribuito secondo i termini e le condizioni della licenza Creative Commons Attribution (CC BY) ( https://creativecommons.org/licenses/by/4.0/ ).







Commenta per primo